前列腺癌是一种严重威胁男性健康的恶性肿瘤,其发病率和死亡率在全球范围内都较高。在前列腺癌的发展过程中,肿瘤细胞会利用内质网应激反应(Unfolded Protein Response, UPR)这一细胞应激途径来促进自身的生存和增殖。IRE1α作为UPR的关键组成部分之一,在多种肿瘤中的作用受到了广泛关注。
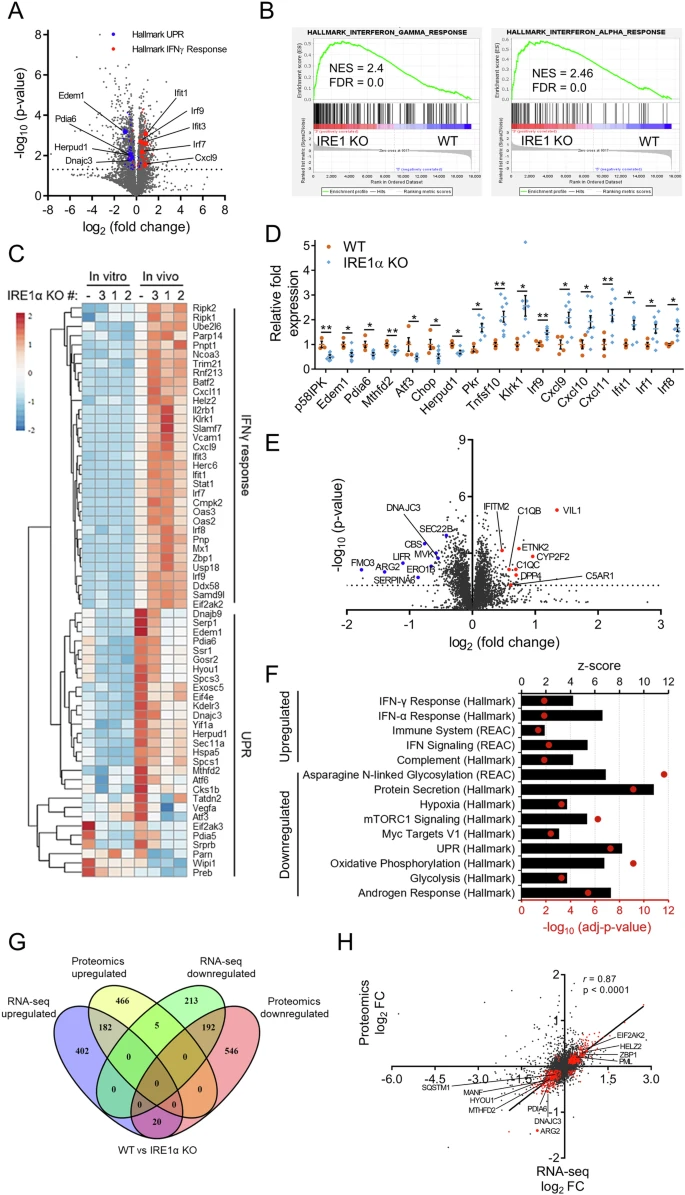
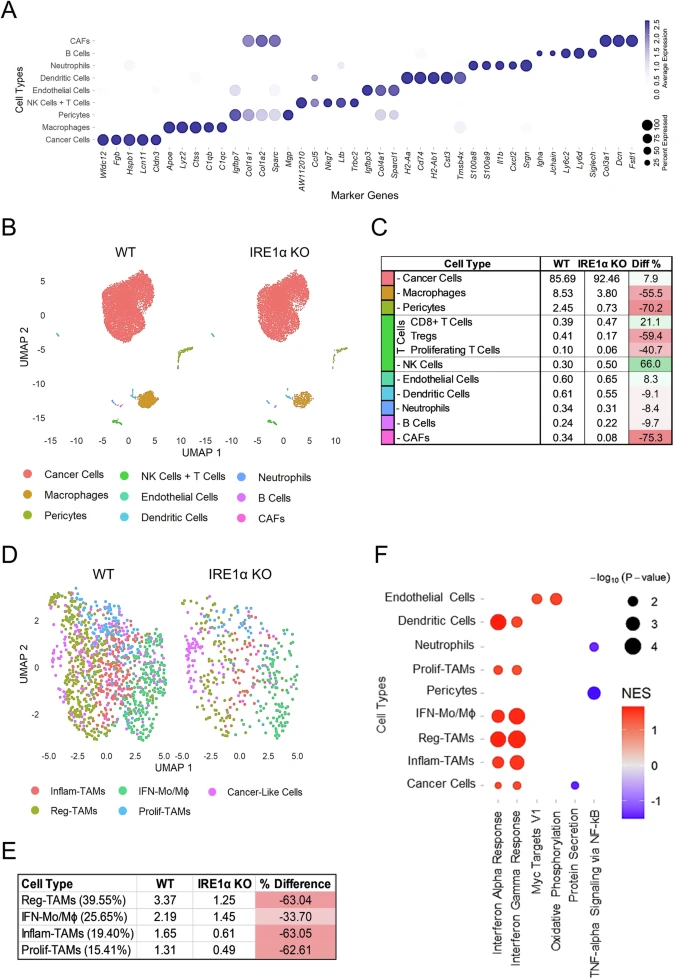
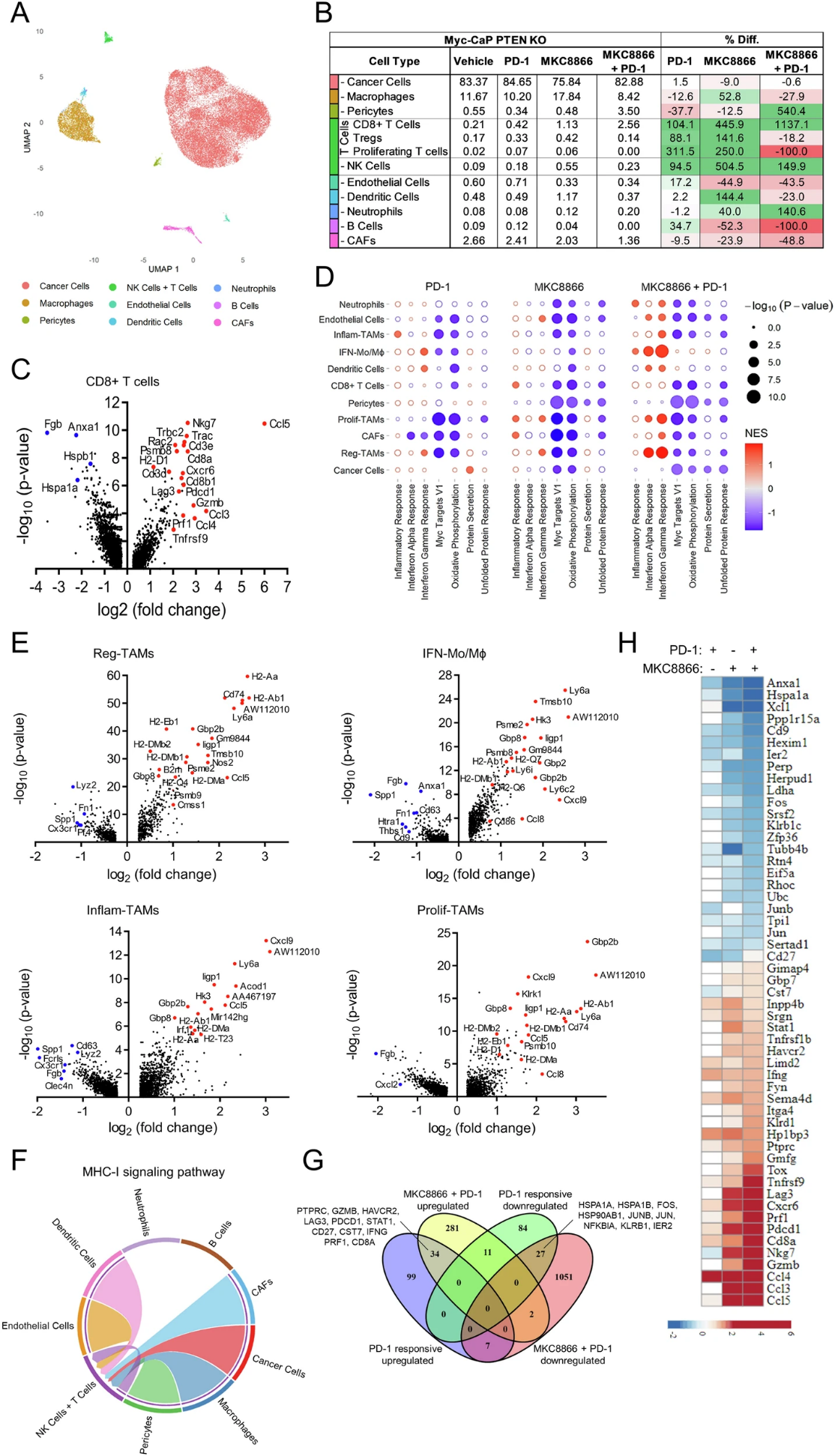
2024年,题为“Targeting IRE1α reprograms the tumor microenvironment and enhances anti-tumor immunity in prostate cancer”的研究论文在《Nature Communications》发表。该研究深入探讨了IRE1α信号通路在前列腺癌(PCa)中的作用,并发现其在患者肿瘤样本中的表达增加。通过在小鼠前列腺癌模型中抑制IRE1α,研究人员观察到肿瘤生长显著减缓,并且肿瘤微环境(TME)中的免疫反应得到增强。这项研究不仅揭示了IRE1α信号通路在促进癌细胞生长和生存中的关键作用,还展示了其在调节肿瘤微环境中抗肿瘤免疫反应中的重要作用。这些发现为开发新的治疗策略提供了重要信息,特别是在提高前列腺癌患者对免疫疗法的响应方面具有重要意义。
新格元在该研究中提供了SCelLiVe组织保存液和组织解离液、单细胞转录组(GEXSCOPE)测序和Celescope分析软件等。