Nat Commun.项目文章 | 揭秘肝脏转移癌中巨噬细胞的异质性和可塑性
发布时间:2024-12-27 10:42:58
炎症信号导致循环单核细胞的募集,并诱导其分化为促炎巨噬细胞。因此,阻断炎性单核细胞是否可以缓解疾病进展正在积极评估中。
研究采用了多谱系追踪模型,并表明单核细胞衍生的巨噬细胞(mo-mac)是免疫抑制、肝转移相关巨噬细胞(LMAM)的主要群体,而库普弗细胞(KC)作为肝驻留巨噬细胞的比例在转移结节中有所降低。矛盾的是,在多种单核细胞缺失小鼠模型中,LMAM数量仅略有下降。在单核细胞缺乏背景下使用增殖记录系统和KC追踪模型,发现LMAMs可以通过增加局部巨噬细胞增殖或促进KC浸润来补充。在后一种情况下,KCs经历短暂的增殖,浸润转移瘤,以填补因单核细胞缺失而产生的生态位空缺。在这一过程中,库佛氏细胞通过表观重编程发生了表型和功能的改变,其形态和转录组与单核来源的巨噬细胞相似,发挥了免疫抑制的作用。作者指出,同时抑制单核细胞浸润和巨噬细胞增殖可以有效减少转移瘤中的巨噬细胞,改善免疫微环境,提高免疫检查点疗法的效果。

肝转移是胃肠道癌症和乳腺癌患者常见的继发性恶性肿瘤,是癌症进展的一种侵袭性形式,预后令人失望,治疗选择有限。免疫疗法在一些癌症中引起了持久的治疗反应,但在肝转移中无效,肝转移富含各种免疫抑制细胞和瘫痪的效应细胞和细胞毒性T细胞。
肿瘤相关的肝髓细胞由炎性单核细胞和巨噬细胞组成,在肝转移中大量存在,并通过诱导细胞毒性T细胞凋亡来培养全身免疫沙漠微环境。除了T细胞外,肝髓系细胞还通过促进血管生成、诱导纤维化、重塑细胞外基质来调节转移的微环境。精确靶向促肿瘤髓系细胞的治疗方法可能有希望,但由于缺乏对肝转移相关巨噬细胞(LMAM)起源和功能维持的了解而受到阻碍
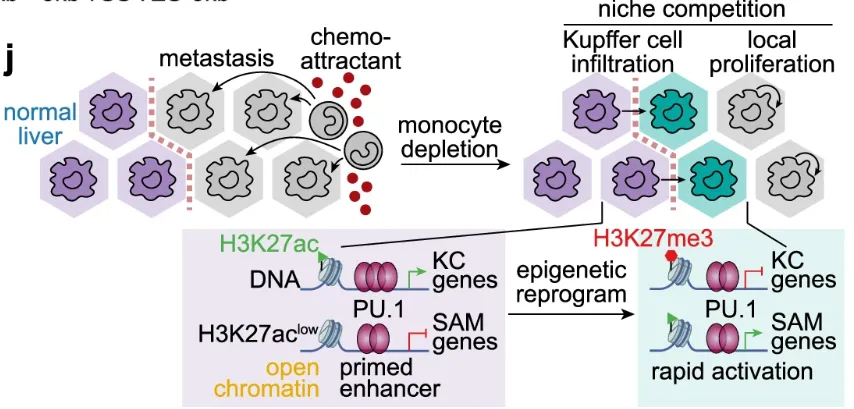
LvMet中KC表型和功能改变的基础是表观遗传重编程(图源自Nature Communications )
在健康的肝脏中,自我更新的驻留巨噬细胞,也称为库普弗细胞(KC),排列在正弦血管上,处于清除门静脉中不合适的红细胞甚至非凋亡的播散性肿瘤细胞的最佳位置。炎症环境通过破坏KC生态位和触发血液单核细胞及其分化的巨噬细胞的流入来破坏组织稳态。然而,由于缺乏明确的KC追踪证据,因此很难描述两种可能性:1)单核细胞衍生巨噬细胞(mo-mac)替代KC;2)KC的表型可塑性。
通过绘制mo macs和KC的命运来剖析不同髓系谱系对LMAM库的贡献,研究发现了两种不同的机制——局部增殖和KC浸润——当循环单核细胞的供应被阻断时,它们会补充LMAMs。在KCs浸润转移性结节后,炎症线索可以部分消除KCs的个体表观遗传记忆,并重新编程KCs,使其类似于巨噬细胞。值得一提的是,为了研究这一可塑性过程,作者在单细胞测序中将WPRE元件作为DNA标签,以对库佛氏来源的细胞进行追踪,新格元为其提供了个性化的分析。研究结果阐明了LMAM对单核细胞阻断的弹性以及以前被低估的组织驻留巨噬细胞的可塑性,强调了同时阻断单核细胞和分化的巨噬细胞以靶向促进肿瘤的骨髓生成以及将转移微环境从免疫抑制转变为免疫刺激的重要性。
参考:
https://www.nature.com/articles/s41467-024-53659-7








