Cell Research 项目文章丨LKB1失活可促进前列腺癌表观遗传重塑诱导的谱系可塑性和抗雄激素耐药性
发布时间:2025-03-10 13:58:01
以下内容转载自iNature:
表观遗传调控通过调节必需基因表达,深刻影响癌细胞的命运及其在谱系之间切换的能力,从而塑造肿瘤异质性和治疗反应。
近日,研究者在Cell Research上在线发表题为“LKB1 inactivation promotes epigenetic remodeling-induced lineage plasticity and antiandrogen resistance in prostate cancer”的研究论文。在去势抵抗性前列腺癌(CRPC)中,雄激素受体(AR)非依赖性谱系可塑性背后的复杂性仍不清楚,导致缺乏有效的临床治疗方法。
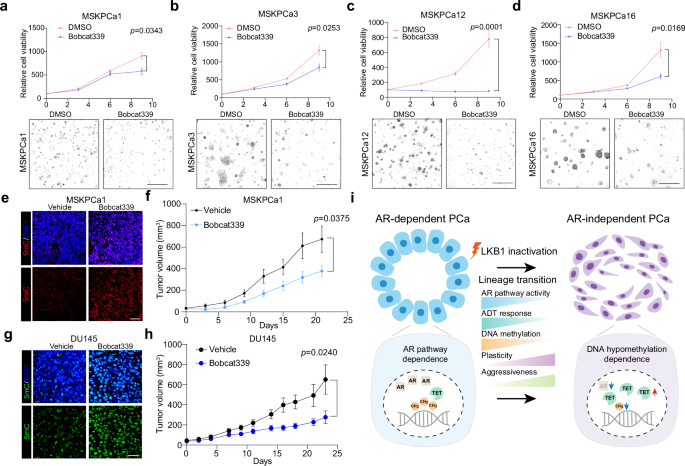
利用人类和小鼠前列腺癌样本的单细胞RNA测序,结合全基因组亚硫酸氢盐测序和多个基因工程小鼠模型,研究了AR非依赖性谱系可塑性的分子机制,并发现了一种潜在的治疗策略。雄激素剥夺治疗前后人前列腺癌的单细胞转录组学分析揭示了肝激酶B1(LKB1)通路失活与AR非依赖性之间的关联。LKB1失活导致前列腺癌进展过程中AR非依赖性谱系可塑性和整体DNA低甲基化。重要的是,发现TET酶的药理学抑制和补充S-腺苷甲硫氨酸可有效抑制AR非依赖性前列腺癌的生长。这些见解阐明了驱动AR非依赖性谱系可塑性的机制,并通过靶向AR非依赖性CRPC中的DNA低甲基化提出了一种潜在的治疗策略。

表观遗传调控通过改变对确定细胞特性和状态至关重要的基因表达,从而影响肿瘤内的多样性及其对治疗的应答,在决定癌细胞的命运及其发生谱系转变的能力方面发挥着关键作用。谱系可塑性,即细胞改变其身份和获得新生物学特性的能力,已被公认为对靶向治疗产生耐药性的关键因素,尤其是在癌症情况下。在前列腺癌中,雄激素受体(AR)信号通路对于管腔癌细胞的增殖和存活至关重要,这使得雄激素剥夺疗法(ADT)最初对患者有益。
然而,大多数患者会发展成一种被称为去势抵抗性前列腺癌(CRPC)的致命形式。虽然神经内分泌前列腺癌(NEPC)代表了CRPC中谱系可塑性的一个经过充分研究的例子,但其潜在的驱动因素和治疗方法越来越被确定,大多数AR无效肿瘤不表现出神经内分泌表型,而是被归类为双阴性前列腺癌(DNPC),这与CRPC亚型中最差的临床结果相关。驱动DNPC的分子机制在很大程度上仍未被探索,严重阻碍了DNPC有效治疗方案的开发。
靶向DNA低甲基化抑制人类AR非依赖性前列腺癌(摘自Cell Research)
在这项研究中,证明了LKB1通路的失活诱导了谱系可塑性,并在前列腺癌中造成了DNA甲基化恢复的脆弱性。通过在ADT前后对人类前列腺癌样本进行单细胞转录组分析,研究了分子和细胞对ADT的反应。研究结果表明,减弱的LKB1通路活性与前列腺癌细胞中的AR非依赖性有关。LKB1缺失促进了前列腺癌中 AR非依赖性谱系转化以及整体DNA低甲基化。重要的是,通过对TET酶的药理学抑制或补充内源性代谢物S-腺苷甲硫氨酸(SAM)来靶向DNA低甲基化已被证明可有效抑制AR非依赖性CRPC的生长。
总的来说,这些结果强调了代谢失调和表观遗传重塑在驱动谱系可塑性和支持 AR非依赖性前列腺癌的致瘤性扩张方面的复杂关系。
参考消息:
https://doi.org/10.1038/s41422-024-01025-z








