项目文章|NC:单细胞转录组解析骨肉瘤异质性及免疫微环境
发布时间:2020-12-21 13:07:03

骨肉瘤(Osteosaroma,OS)是一种高侵袭性的恶性骨肿瘤,多见于儿童和青少年,全球每年发病率约为百万分之五[1,2]。骨肉瘤被认为起源于原始间充质的成骨类细胞,通常发生在儿童和青年快速生长的腿部或手臂末端附近的骨骼中[3]。其标准治疗方式包括手术切除和化疗,对于不能切除的肿瘤推荐放射治疗[4]。目前患者5年总存活率仅为66.2%,复发及转移率保持在30%以上[5]。由于复发及转移患者对化疗或放射治疗会逐渐产生抗性,其5年总存活率小于25%[6]。因此,迫切需要了解骨肉瘤发生发展的分子机制,寻找更有效的治疗靶点。
针对以上问题,本研究利用新格元公司平台技术解离了骨肉瘤7个原发灶、2个复发灶和2个肺转移灶组织,并通过单细胞测序技术获得100,987个单细胞的转录组信息[7]。通过聚类得到11个主要的细胞类型,包括成骨细胞型骨肉瘤细胞、增殖期成骨细胞型骨肉瘤细胞、软骨母细胞型骨肉瘤细胞、破骨细胞、肿瘤浸润性淋巴细胞(TIL,包括T细胞和NK细胞)、髓系细胞、成纤维细胞、间充质干细胞(MSCs)、周细胞、成肌细胞和内皮细胞[图1]。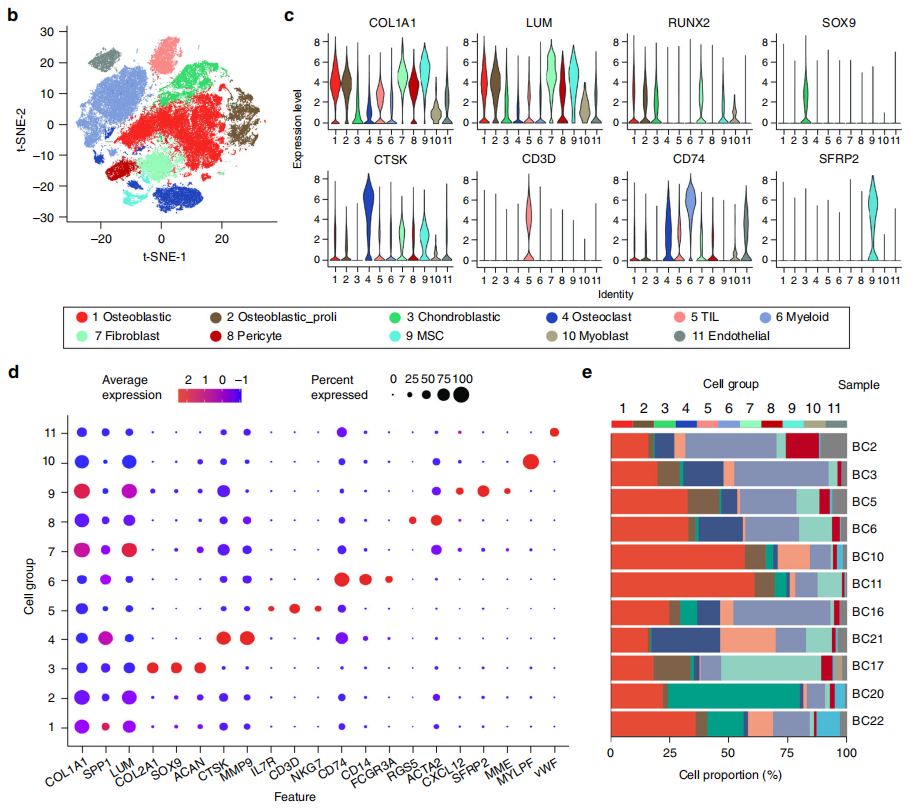
图1 骨肉瘤细胞图谱
为了系统分析骨肉瘤恶性细胞异质性,进一步将恶性细胞细分为7个亚群,其中6个亚群为成骨细胞型骨肉瘤细胞,1个亚群为软骨母细胞型骨肉瘤细胞。通过GSEA及GO富集分析,揭示了各细胞亚型转录组涉及的信号通路特征,发现与成骨细胞型骨肉瘤相比,软骨母细胞型骨肉瘤恶性细胞高表达与软骨细胞分化、胶原纤维形成、软骨发育相关的基因。然后利用inferCNV 算法分析了恶性细胞的拷贝数变异(CNVs)特征,并基于此数据研究不同恶性细胞亚型之间的克隆进化关系,发现恶性成骨细胞可能是由恶性软骨母细胞分化而来。进一步通过Monocle 2 和Slingshot 算法进行拟时轨迹分析,发现软骨母细胞可分化为成骨细胞和软骨内成骨,并且在软骨母细胞分化过程中,不仅高表达与成骨细胞分化、成骨和骨形态发生相关的基因,而且高表达与组蛋白甲基化和乙酰化相关的基因。这些结果再次显示,表观遗传修饰可能在很大程度上促进了恶性软骨母细胞向恶性成骨细胞的分化[图2]。
接下来研究人员还系统分析了骨肉瘤中破骨细胞、间充质干细胞以及成纤维细胞在不同病变组织中的细胞转录特性、调控因子及动力学特征。破骨细胞在骨溶解和肿瘤生长支持中起着重要作用,间充质干细胞可能会刺激肿瘤细胞的增殖、转移和耐药性,成纤维细胞也与骨肉瘤的疾病特征密切相关。
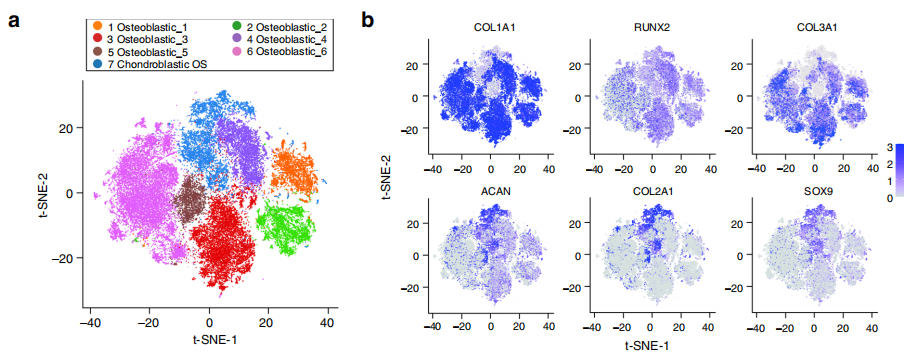

图2 恶性细胞CNVs及克隆进化分析
肿瘤免疫微环境对疾病的发生发展起着至关重要的作用。细分组织中的髓系细胞得到10个不同的细胞亚群,包括单核细胞、TAMs、DC和中性粒细胞等,单核细胞和巨噬细胞占病变组织中髓系细胞总数的70-80%。细分骨肉瘤相关巨噬细胞(TAMs)群体得到3个细胞亚型,其中占比最多的是M2型TAMs,并在肺转移癌灶组织中发现了促炎性FABP4+巨噬细胞。TILs细胞被细分为8个亚型,包括CD4−CD8−T细胞、 CD8+ T细胞、CD4+ T细胞、T-reg细胞、增殖性T细胞、NKT细胞、NK细胞和B细胞。与原发病灶相比,肺转移和复发病灶中T细胞介导的肿瘤抑制活性较弱。CD8+ T细胞高表达T细胞耗竭抑制性受体基因TIGIT 和 LAG3,提示肿瘤中CD8+T细胞在初始激活阶段后迅速耗竭。此外,数据显示TIGIT还在T-reg细胞、CD4+T细胞和NKT细胞中广泛表达,提示骨肉瘤患者有可能受益于TIGIT阻断治疗。近年来,抗TIGIT药物通过调节CD8+T细胞、T-reg细胞和NK细胞的活性,在治疗结直肠癌、乳腺癌和黑色素瘤方面起到积极作用。本项目中研究人员分别提取高表达和低表达TIGIT的肿瘤浸润CD3+T细胞,利用抗TIGIT抗体在体外共培养体系中检测两种CD3+T细胞对骨肉瘤恶性细胞的细胞毒力。结果表明,阻断TIGIT信号可显著增强高表达TIGIT的CD3+T细胞对骨肉瘤细胞的杀伤率,提示靶向TIGIT治疗对骨肉瘤有潜在的治疗价值[图3]。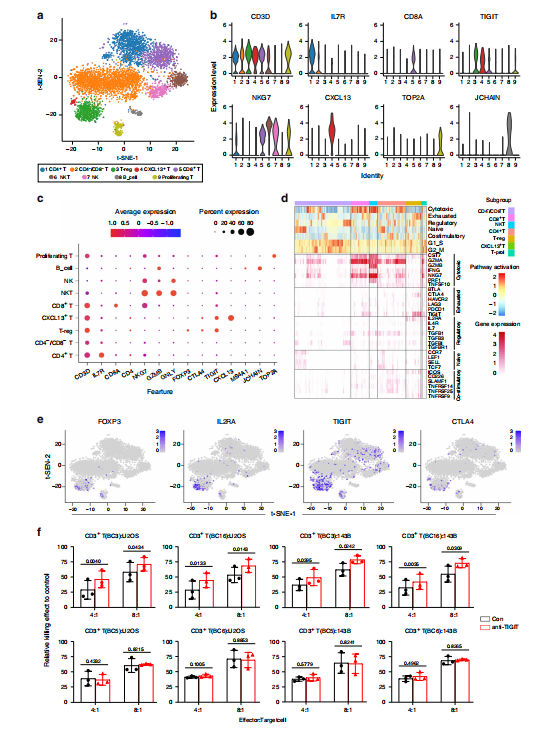
图3 肿瘤浸润性淋巴细胞(TIL)聚类和功能分析
综上所述,本研究全面绘制了骨肉瘤组织的单细胞图谱,并对其中各类型细胞的转录特性、调控因子及动力学特征进行了系统分析,展示了骨肉瘤细胞的高度异质性,提出成骨型恶性细胞可能是由软骨母细胞型恶性细胞转化而来。相较于原发成骨细胞型骨肉瘤病变,软骨母细胞型骨肉瘤病变、复发性骨肉瘤病变和肺转移骨肉瘤病变组织中破骨细胞浸润程度较低。通过解析肿瘤免疫微环境,发现在肺转移性骨肉瘤病变组织中可见促炎症细胞FABP4+巨噬细胞浸润,并提出阻断TIGIT信号增强了原始CD3+T细胞和高表达TIGIT免疫细胞对骨肉瘤恶性细胞的杀伤性,为骨肉瘤临床治疗提供了理论指导。
参考文献
1. Pingping, B. et al. Incidence and Mortality of Sarcomas in Shanghai, China, During 2002–2014. Front. Oncol. 9, 662 (2019).
2. Lancia, C. et al. A novel method to address the association between received dose intensity and survival outcome: benefifits of approaching treatment intensifification at a more individualised level in a trial of the European Osteosarcoma Intergroup. Cancer Chemother. Pharmacol. 83, 951–962 (2019).
3. Mutsaers, A. J. & Walkley, C. R. Cells of origin in osteosarcoma: mesenchymal stem cells or osteoblast committed cells? Bone 62, 56–63 (2014).
4. Ciernik, I. F. et al. Proton-based radiotherapy for unresectable or incompletely resected osteosarcoma. Cancer 117, 4522–4530 (2011).
5. Duggan, M. A. et al. The surveillance, epidemiology, and end results (SEER) program and pathology: toward strengthening the critical relationship. Am. J. Surg. Pathol. 40, e94–e102 (2016).
6. Zhao, J. et al. Emerging next-generation sequencing-based discoveries for targeted osteosarcoma therapy. Cancer Lett. 474, 158–167 (2020).
7. Zhou, Y. et al. Single-cell RNA landscape of intratumoral heterogeneity and immunosuppressive microenvironment in advanced osteosarcoma. Nature Communications. 11, 6322 (2020).








